Лекция 3
| Сайт: | Satbayev University - Институт дистанционного обучения |
| Курс: | Промышленный катализ / Айткалиева Гульзат Сляшевна |
| Book: | Лекция 3 |
| Printed by: | Қонақ |
| Date: | сейсенбі, 16 желтоқсан 2025, 6:22 PM |
1. Лекция №3. Технологические характеристики промышленных катализаторов. Катализ и охрана окружающей среды.
Гетерогенный катализ доминирует в химических промышленных производствах, в частности, в силу своей большей технологичности. Основные технологические характеристики гетерогенных катализаторов:
Активность. Этот термин объединяет несколько характеристик. В тех случаях, когда сопоставляются каталитическая и некаталитическая реакции, в качестве единицы активности катализатора в системе СИ принят катал (обозначение: кат, kat).
Активность, равная одному каталу означает, что введение катализатора увеличивает скорость химической реакции на один моль в секунду. Активность можно также характеризовать отношением констант скоростей каталитической и некаталитической реакций:
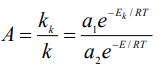
Поскольку
предэкспоненты ai обычно близки, справедливо приближение 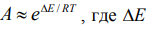 выигрыш в
энергии активации за счет использования катализатора. Например, активность
ванадиевого катализатора в реакции 2SO2 + O2 = 2SO3
равна ~3· 1011, т. е. скорость
реакции возрастает в сотни миллиардов раз. В большинстве случаев катализатор
также снижает порядок реакции. Так, для указанной реакции без катализатора он
равен 3, а с ванадиевым катализатором – 1.8.
выигрыш в
энергии активации за счет использования катализатора. Например, активность
ванадиевого катализатора в реакции 2SO2 + O2 = 2SO3
равна ~3· 1011, т. е. скорость
реакции возрастает в сотни миллиардов раз. В большинстве случаев катализатор
также снижает порядок реакции. Так, для указанной реакции без катализатора он
равен 3, а с ванадиевым катализатором – 1.8.
Если нужно сравнить активность двух катализаторов, используют иную величину – частоту оборотов катализатора. Она равна отношению начальной (или стационарной) скорости реакции к начальной концентрации активных в каталитическом процессе центров Со:
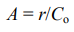
Определенная
таким образом величина активности меняется в случае химических катализаторов в
диапазоне от 10–3 до 104 с –1. В
ферментативных процессах она достигает 106 с –1. Обратная
величина характеризует время одного каталитического цикла. В гетерогенном
катализе активность, как правило, пропорциональна удельной поверхности. Поэтому
преимущество имеют пористые или нанесенные катализаторы. Температура зажигания
– минимальная температура, при которой процесс начинает протекать с достаточной
для технологических целей скоростью. Температура зажигания тем ниже, чем выше
активность катализатора: 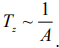 .
.
Чем ниже температура зажигания, тем больше рабочий диапазон катализатора.
Селективность – способность катализатора избирательно ускорять одну из реакций, если в системе термодинамически возможно протекание нескольких реакций. Простым примером являются реакции в смеси СО и Н2. На медьсодержащем катализаторе молекулы водорода хемосорбируются диссоциативно, а молекулы СО – недиссоциативно.
В результате перегруппировки образуется переходный комплекс Н–кат– CH2OH. В итоге с очень высоким входом образуется метанол. В присутствии никелевого катализатора как СО, так и Н2 хемосорбируются на поверхности диссоциативно, и образуется комплекс кат–СН3.
Конечными продуктами реакции в этом случае будут СН4 и Н2О. Чем больше реакций может протекать в системе, тем острее стоит вопрос поиска высокоселективного катализатора. Селективность катализатора характеризуют отношением скорости vi реакции, ведущей к накоплению целевого продукта, к сумме скоростей превращения исходных веществ во всех возможных реакциях:
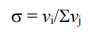
Другой величиной, используемой для характеристики селективности, служит отношение количества целевого продукта к суммарному количеству продуктов (обычно выражается в процентах).
Пористость катализатора (контактной массы) характеризует его удельную поверхность и, тем самым, поверхность контакта. Пористость выражается отношением свободного объема пор к общему объему катализатора и характеризуется удельной поверхностью, т. е. поверхностью, отнесенной к единице массы или объема катализатора. Современные катализаторы имеют весьма развитую поверхность, достигающую 10–100 м2/г.
Интересным примером металлического катализатора с большой удельной поверхностью является никель Ренея. Его получают следующим образом. Металлический никель сплавляют с алюминием или кремнием, и затем сплав обрабатывают щелочью. В результате получают никелевый катализатор с высокой удельной поверхностью, иногда пирофорный.
Одним из современных методов получения тонкодисперсных катализаторов с высокой удельной поверхностью является распылительная сушка. Раствор или суспензию катализатора впрыскивают через форсунки малого диаметра в верхнюю часть камеры, в которой поддерживается температура, необходимая для испарения жидкости из падающих капель. В результате в нижней части камеры собираются однородные частицы почти сферической формы с радиусом ~100 мкм. Таким образом поучают, например, алюмосиликатные катализаторы.
Увеличение удельной поверхности катализатора имеет верхний предел. При очень развитой поверхности (очень высокой пористости) реакция может перейти в диффузионную область.
Механическая прочность. Требования к механической прочности катализатора различны в случае контактных аппаратов с неподвижным и подвижным слоем. В первом случае не должен разрушаться монолитный катализатор, во втором должна быть обеспечена устойчивость к истиранию.
Каталитическая активность и понижение механической прочности твердого тела представляют собой сопряженные стороны одного и того же явления – взаимодействия твердого тела с реакционной средой, в результате которого изменяются химические связи в структуре катализатора. В частности, рентгенографические исследования свидетельствуют о том, что в ходе каталитической реакции возрастают внутренние напряжения в структуре катализатора.
Изменения структуры твердого тела, благоприятные с точки зрения каталитической активности, обычно неблагоприятны с точки зрения прочности, и наоборот. Немаловажную роль играет, в частности, адсорбционное понижение прочности. Поэтому поиск модификаторов, одновременно увеличивающих и активность и прочность катализатора, является нетривиальной задачей. Это одна из актуальных задач современной химии твердого тела.
Устойчивость к контактным ядам. Отравление катализатора может быть обратимым или необратимым. Контактные яды могут не только поступать с реагентами, но и образовываться в качестве побочных продуктов в ходе самого процесса. Активность катализатора снижают также пыль, кокс, полимерные пленки, образующиеся на его поверхности в ходе реакции. Регенерация катализаторов также специфична, как и отравление.
Термостойкость. Требования к термостойкости определяются необходимостью избежать деактивации катализатора, обусловленной его рекристаллизацией. Для предотвращения рекристаллизации катализаторы наносят на термостойкие носители, в некоторых случаях – на носители с высокой теплопроводностью. Например, катализаторы глубокого окисления углеводородов наносят на нихромовую проволоку.
Гидродинамические характеристики важны при использовании контактных аппаратов с подвижным слоем. Гидравлическое сопротивление слоя катализатора уменьшается с ростом размера гранул и доли свободного объема между ними. Однако при очень больших размерах процесс может перейти в диффузионную область. Для обеспечения хороших гидродинамических характеристик катализаторы изготавливают в форме специальных таблеток или колец.
Время жизни. Катализатор не участвует в стехиометрии основной реакции. Соответственно, теоретически он и не расходуется. Однако неизменность химического состава и структуры катализатора в ходе каталитического процесса – требование идеальное. Обычно из промышленного реактора выгружают совсем не то, что в него загрузили вначале. Неизменность имеет смысл рассматривать только по отношению к той из элементарных стадий сложной каталитической реакции, в которой непосредственно участвует катализатор. В реальности он может отравляться, истираться, закоксовываться, уноситься из зоны реакции и т. д. Время жизни промышленных катализаторов колеблется от нескольких часов до 2–3 лет.
Стоимость. Если катализатор используется для производства уникального дорогостоящего продукта, его стоимость может и не иметь особого значения. При многотоннажном производстве стоимость катализатора должна лежать в разумных пределах. Обычно это несколько процентов от стоимости продукта. При крекинге нефти стоимость катализатора составляет менее 1 %; при производстве аммиака с использованием железного катализатора – 1–2%; при производстве акрилонитрила – 5 %; при производстве формальдегида из метанола с использованием серебряного катализатора – до 8 %. Самые дорогие катализаторы – платиновые.
Систематическое использование катализа для решения проблем охраны окружающей среды – относительно новое и очень важное для улучшения качества жизни направление современной химической технологии. Условно его можно подразделить на два: очистка промышленных и бытовых выбросов. Примером первого может служить уменьшение содержания оксидов азота, образующихся при сжигании природных топлив на теплоэлектростанциях. Для этого в них добавляют небольшое количество аммиака и пропускают через титанованадиевый катализатор.
Проблемы промышленной очистки во многих случаях решаются в комплексе с другими технологическими проблемами конкретного производства.
Одна из самых масштабных бытовых проблем – очистка выхлопных газов автомобилей. В начале 1950-х годов было установлено, что углеводороды и оксиды азота, входящие в состав выхлопных газов, реагируют на свету с образованием оксидантов (в частности, озона), которые оказывают различные негативные воздействия на организм человека. В 1970 году была сформулирована Декларация о чистом воздухе, в соответствии с которой все новые автомобили, начиная с моделей 1975 года, должны снабжаться каталитическими очистителями выхлопных газов. Эта декларация (уточнявшаяся затем в 1977 и 1990 годах) устанавливает, в частности, нормы для состава выхлопных газов.
В современных очистителях в качестве катализаторов используют платину, палладий или родий, нанесенные на оксид металла (например, Al2O3). Интересно отметить, что изучение механизмов окисления СО на металлах платиновой группы с прикладной целью очистки выхлопных газов в самой значительной степени способствовало решению академической задачи понимания природы колебательных режимов в гетерогенном катализе, о которых речь шла выше. Это одна из областей тесного сближения фундаментальной и прикладной химии.