Лекция 10
| Сайт: | Satbayev University - Институт дистанционного обучения |
| Курс: | Промышленный катализ / Айткалиева Гульзат Сляшевна |
| Книга: | Лекция 10 |
| Напечатано:: | Гость |
| Дата: | понедельник, 15 декабря 2025, 05:17 |
1. Лекция 10. Полное окисление: катализаторы и механизм их действия
Катализаторы окисления:
1. Оксиды переходных металлов, в которых кислород легко входит в структуру и легко извлекается из нее. Большинство промышленных катализаторов – смешанные оксиды, содержащие два или более катионов.
2. Металлы, на поверхности которых хемосорбирован кислород. Например – серебряный катализатор окисления этилена в этиленоксид, Pt сетка, используемая для окисления аммиака в оксид азота.
3. Оксиды металлов, на поверхности которых активным является хемосорбированный кислород (в виде молекул или атомов).
Процессы окисления кислородом воздуха играют большую роль как в природе, так и в промышленности. С одной стороны, эти процессы поставляют энергию при окислении органических веществ в биосистемах−живых организмах и растениях, а с другой стороны, позволяют получать различные по составу и строению кислородсодержащие соединения. С помощью процесса окисления углеводородов получают спирты, альдегиды, кислоты, гидропероксиды, многие другие промышленно важные соединения.
Процессы окисления органических соединений проводят в присутствии различного типа катализаторов:
а) катализаторы мягкого окисления позволяют из углеводородов получать различные кислородсодержащие соединения (оксиды олефинов, альдегиды, ангидриды, кислоты), к ним относятся серебро, закись меди, V2O5 и
б) катализаторы жёсткого окисления, в присутствии которых происходит полное сгорание углеводородов до СО2 и H2О. К ним относятся шпинели (хромит магния, меди и др.), металлы Pt и Pd и оксиды – МnО2, CuO.
В промышленности наиболее широко применяют серебряный катализатор для окисления метанола или синтеза оксида этилена, закись меди для получения акролеина окислением пропилена, пятиоксид ванадия для окисления нафталина, ванадий − титановый оксидный катализатор для окисления ксилолов.
Производство серебряного катализатора. Серебряный катализатор получают из азотнокислого серебра, растворённого в мягкой воде. Водный раствор азотнокислого серебра нагревают до 333К и в него загружают носитель, в качестве которого применяют шариковый алюмосиликатный катализатор (или оксид алюминия, пемзу или карборунд). Пористый носитель предварительно необходимо увлажнять для предотвращения растрескивания шариков или таблеток. Пропитку носителя азотнокислым серебром проводят 0,5 ÷ 1,0 ч. Затем раствор упаривают и сушат при температуре 373÷393К в течение 6 ч до сухого состояния. Перегружают шарики в прокалочную печь и повышают температуру в ней со скоростью 130÷150 град/ч до 1073÷1123K. Шарики перемешивают для исключения их спекания. Прокалку ведут в течение 6 ч. При этом соль разлагается по реакции:
2AgNO3 = 2Ag + 2NO2 + O2.
Оксиды азота поглощают водным раствором щёлочи, в котором
проходит реакция образования солей натрия:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O.
Соли отправляют на переработку. Полученный катализатор содержит от 32 до 36 %масс. Ag.
Катализатор окисления метанола в формальдегид. В качестве катализатора окисления метанола в формальдегид в промышленности применяют железомолибденовый оксидного типа –аFе2O3*bМоO3 – катализатор.
При окислении метанола на этом катализаторе протекает как целевая реакция, позволяющая получать формальдегид и воду, так и большое число побочных реакций, обеспечивающих получение СО и CО2, НСООН, СН3ОСН3, СН3СООН, СН3ОСН3. Синтез катализатора ведут из смеси солей Fe(NO3)3 и (NH4)2MoO3. При взаимодействии этих солей образуется гидрогель молибдата железа по реакции:
2Fe(NO3)3xH2O+3(NH4)2MoO3=Fe2(MoO4)3xH2O+6NH4NO3+(12–x)H2O.
Гель получают в стекловидной форме. Его промывают умягчённой водой, отфильтровывают воду, сушат, дробят, добавляют уголь и прессуют в таблет-машине. Прокаливание таблеток проводят дымовыми газами при температуре Т= 670К и ниже с целью предотвращения разложения молибдата железа. Катализатор имеет насыпную плотность 1800 кг/м3, усилие на раздавливание таблеток составляет свыше 100 кг/см2.
Превращение
метанола при 603К и давлении 1,5 бар составляет 98-99,5%масс., при
селективности 98%масс. Активность железо- оксидного катализатора зависит от
соотношения исходных солей и состава катализатора, рассчитанного по оксидам Fее2O3
и МоO3. Оптимизацию состава катализатора для реакции окисления метанола можно
провести с помощью теории катализа полиэдрами. В структуре железомолибденового
катализатора в качестве активных ансамблей являются тетраэдры 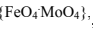 , а менее
активными ансамблями полиэдров являются следующие:
, а менее
активными ансамблями полиэдров являются следующие: 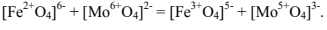
В катализаторе наиболее высокую каталитическую активность проявляют тетраэдры, число окисления которых создаётся вследствие перераспределения электронов по схеме (условная схема):
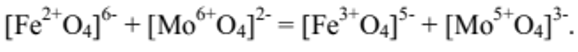
Состояние
указанных в правой части тетраэдров определяется с помощью спектров ЭПР. Катализатору
можно приписать общую формулу 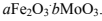
При оптимизации состава этого катализатора по термодинамическому методу, приведенному ранее. Установлено, что максимальной каталитической активностью должен обладать катализатор состава Fе2O3*2МоO3.
Ванадий-титановый оксидный катализатор на фарфоровых шариках. Ванадий-титановый оксидный катализатор применяют в промышленности для окисления ксилолов (орто-, мета- и пара-) кислородом воздуха во фталевые кислоты (фталевую, изофталевую и терефталевую). Его производство включает подготовку носителя, приготовление водного раствора ванадил-оксалата, водных растворов HNO3 и этиленгликоля. В смесительную ёмкость загружают фарфоровые шарики и промывают их умягчённой водой.
Затем готовят водный раствор ванадил-оксалата. В реактор загружают V2O5,добавляют к нему воду, нагревают до 358К и при перемешивании добавляют к смеси щавелевую кислоту. В реакторе проходит реакция синтеза ванадил-оксалата:
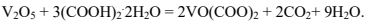
Кислоту в реактор добавляют небольшими порциями, так как из реакционной смеси выделяется СО2. Затем, по окончании реакции, к смеси добавляют NH4NO3 и TiO2. В реактор перегружают промытые фарфоровые шарики. Смесь нагревают при Т=348К и к ней подают этиленгликоль. При этой температуре нагревают смесь ещё 1 ч. Воду упаривают и получают катализатор, который перегружают в сухом виде в реактор для прокаливания. Его прогревают в токе воздуха при Т=583К до полного прекращения выделения газов.
Получают катализатор следующего химического состава, %масс.: V2O5 – 0,25÷0,4; TiO2 – 5÷6; остальное – фарфоровые шарики, насыпная плотность – 1320 кг/м3.
Можно катализатор получать путем опрыскивания шариков из форсунок пропиточными растворами ванадила-аммиака и с добавкой оксида титана