Лекция 5

Лекция 5
1. Лекция 5. Технология каталитических процессов. Каталитический крекинг: химизм, механизм и аппаратурное оформление процесса
Создание процесса каталитического крекинга было обусловлено необходимостью смягчить условия крекинга нефтяных продуктов (понизить температуру и давление), повысить выход бензина и улучшить его качество. Наиболее активным катализатором крекинга углеводородов является хлорид алюминия. Впервые крекинг в присутствии АlВг3 и АlС13 был проведен в России Г. Г. Густавсоном. Под действием хлорида алюминия крекинг, например, парафина начинается при 100°, а при 200 °С протекает с высокой скоростью. Недостатки процесса крекинга в присутствии этого катализатора состоят в повышенном расходе хлорида алюминия и невозможности его регенерации, а также в том, что при его разложении под действием влаги воздуха выделяется хлорид водорода, сильно корродирующий аппаратуру.
Процесс каталитического крекинга является основным процессом, направленным на углубление переработки нефти как за рубежом, так и в России. Целевым назначением процесса является получение высококачественного компонента автобензина с октановым числом 85-93 (ИМ).
Основным сырьем современных промышленных установок каталитического крекинга являются атмосферные и вакуумные дистилляты первичной перегонки нефти. В зависимости от фракционного состава дистиллятное сырье можно отнести к одной из следующих групп.
Первая группа — легкое сырье. К этой группе относятся дистилляты первичной перегонки нефти (керосино-газойлевые и легкие вакуумные погоны). Вторая группа — тяжелое дистиллятное сырье. К этой группе относятся вакуумные дистилляты, выкипающие при температурах от 300 до 560 °С, а также сырье вторичного происхождения, получаемое на установках термического крекинга и коксования. Третья группа — остаточное сырье — мазуты, деасфальтизаты, тяжелые продукты других термокаталитических и термических процессов.
Соединения, содержащиеся в сырье крекинга, можно условно разделить на компоненты, вызывающие только повышенное коксоотложение на катализаторе, и на компоненты, вызывающие обратимое или необратимое дезактивирование катализатора. К первым относятся полициклические ароматические углеводороды и смолы. К компонентам, дезактивирующим катализатор, относятся азотистые и сернистые соединения, а также тяжелые металлы.
При каталитическом крекинге образуется значительное количество газа, богатого пропан-пропиленовой и бутан-бутиленовой фракциями (сырье для производства различных высокооктановых эфиров, алкилатов и других ценных компонентов моторного топлива). Установки каталитического крекинга являются также поставщиком сырья для химической промышленности: из газойлей крекинга получают сажевое сырье и нафталин, тяжелый газойль может служить сырьем для производства высококачественного «игольчатого» кокса.
Каталитический крекинг — типичный пример гетерогенного катализа. Реакции протекают на границе двух фаз: твердой (катализатор) и паровой или жидкой (сырье). При каталитическом крекинге протекают реакции деструкции, алкилирования, изомеризации, ароматизации, полимеризации, гидрогенизации и деалкилирования углеводородов.
В результате следует отметить самые существенные особенности каталитического крекинга:
§ избирательное протекание процесса с малым образованием С1 и С2-содержаших осколков;
§ ясно выраженную изомеризацию углеродного скелета и кратных связей в молекулах олефинов;
§ значительное насыщение С=С-связей (особенно у изомери- зованных олефинов с высокой молекулярной массой);
§ большое количество ароматических и изопарафиновых углеводородов; 5) большее, чем при термическом крекинге коксообразование;
§ значительные выходы бензина с высоким октановым числом (80-81 ММ).
Реакции крекинга углеводородов всех классов, которые встречаются в исходном сырье, могут быть представлены схемой, изображенной на рисунке 1.
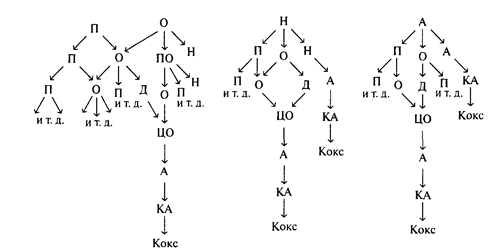
П - парафиновые углеводороды; О - олефины; Н - нафтеновые углеводороды; А - ароматические углеводороды;
ПО - полимеризованные олефины; ЦО - циклические олефины;
Д - диены; КА - конденсированные ароматические углеводороды.
Рисунок 1 – Схема протекания реакций крекинга углеводородов
Для крекинга применяются алюмосиликатные катализаторы. Это искусственно полученные твердые высокопористые вещества с сильно развитой внутренней поверхностью.
Современные катализаторы крекинга содержат в своем составе 3 - 20 % масс. цеолита, равномерно распределенного в матрице. Цеолиты представляют собой алюмосиликаты с трехмерной кристаллической структурой следующей общей формулы:
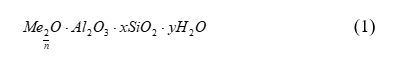
где n - валентность катиона Me;
х - мольное отношение SiO2/AI2O3;
y - число молей воды.
Алюмосиликатные катализаторы представляют собой гранулированные вещества, обладающие высокой удельной поверхностью (400–1000 м2/г). По своей химической природе алюмосиликатные катализаторы являются слабыми кислотами. Так, их можно титровать бутиламином в присутствии индикатора я-диметиламиноазобензола.
Кристаллическая решетка аморфных алюмосиликатов может рассматриваться как трехмерная кристаллическая решетка поликремневой кислоты, в которой часть атомов кремния заменена на атомы алюминия:
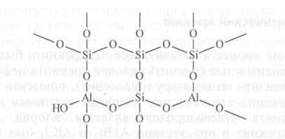
В промышленности синтез аморфного алюмосиликатного катализатора (ААК) проводят следующим способом.
При взаимодействии водных растворов силиката натрия и сульфата алюминия образуется силикат алюминия, который в среде минерального масла под действием поверхностного натяжения превращается в гранулы геля; гранулы после промывки и сушки прокаливают при 600–800 °С.
В лабораторных условиях смешивают в необходимых пропорциях гель гидрата оксида алюминия и гель кремневой кислоты. Из полученной смеси гелей формуют гранулы, которые промывают, высушивают и прокаливают. При прокаливании происходит химическое взаимодействие кремневой кислоты и гидрата оксида алюминия и образуется алюмосиликат.
Химический состав алюмосиликатного катализатора иногда рассматривают как смесь оксида алюминия и оксида кремния, находящихся в химическом соединении, и записывают химическую формулу алюмосиликатного катализатора следующим образом: nАl203 • mSi02 • хН20.
Необходимо отметить, что ни оксид алюминия, ни оксид кремния, взятые в отдельности, не являются катализаторами крекинга. Их механические смеси также неактивны. Однако если добавить к гелю кремневой кислоты даже небольшое количество геля гидрата оксида алюминия, то при прокаливании такой смеси получается активный катализатор крекинга углеводородов. Зависимость активности ААК от содержания химически связанного оксида алюминия изучалась Г. М. Панченковым. Им найдено, что максимум активности катализатора соответствует 30%-ному содержанию оксида алюминия.
В настоящее время в нефтеперерабатывающей промышленности широко применяются кристаллические алюмосиликатные цеолитсодержащие катализаторы крекинга. Эти катализаторы содержат до 20 мас. % цеолитов на аморфной алюмосиликатной матрице. Цеолитсодержащие катализаторы крекинга значительно активнее аморфных (выход бензина выше на 30-50 %).
Наиболее активны катализаторы, содержащие цеолиты типа У. В их присутствии процесс превращения углеводородов идет глубоко. Состав продуктов крекинга с применением ААК и цеолитов существенно различается. Так, бензин, полученный при крекинге на ААК, содержит 30 % ароматических углеводородов, 42 % нафтенов, 12 % олефинов, 12 % алканов; а бензин, полученный из того же сырья на цеолите, содержит 50 % ароматических углеводородов, 22 % нафтенов, 5 % олефинов и 25 % алканов. Однако цеолиты, несмотря на их высокую активность, обычно сами не применяются в качестве катализаторов крекинга, так как вследствие малых размеров пор при крекинге не используется полностью внутренняя поверхность гранул цеолита (крекинг протекает в диффузионной области). Это можно иллюстрировать следующими данными: средний диаметр пор ААК равен 30–50 А, а цеолитов 3–10 А; средний эффективный диаметр молекул полициклических углеводородов в сырье каталитического крекинга может достигать 13–15 А и более. Поэтому применяют цеолитсодержащие катализаторы.
Продукты крекинга (бензин и газ) с применением аморфного и цеолитсодержащего алюмосиликатных катализаторов также различаются по составу, хотя и в меньшей мере, чем с использованием чистых цеолитов.
Температура каталитического крекинга и время контакта сырья и катализатора являются основными факторами, определяющими результаты крекинга.
Наиболее важным параметром следует считать температуру процесса, с повышением которой при постоянной конверсии сырья выход бензина несколько снижается. Значительно увеличивается выход сухого газа и бутан-бутиленовой фракции, заметно уменьшается выход кокса и практически неизменным остается выход циркулирующего газойля.
Повышение температуры реакции преимущественно влияет на октановое число тяжелых бензинов и в меньшей мере — на октановое число легких бензинов, что определяется значительным содержанием олефиновых и ароматических углеводородов в тяжелых бензинах при глубоких видах крекинга.
Типичным для промышленных систем крекинга является температурный интервал 450-550 °С.
При увеличении массовой скорости подачи сырья наблюдается снижение выхода газа и кокса во всем диапазоне температур, выход же бензина снижается при температурах процесса 460-490 °С и возрастает при 510-590 °С.
Существенное значение имеет также кратность циркуляции катализатора, являющегося одновременно теплоносителем, вносящим в зону реакции основную часть тепла, необходимого для нагрева сырья до температуры крекинга и компенсации эндотермического эффекта процесса.
Давление в реакторе составляет от 0,13 до 0,28 МПа в зависимости от технологического режима и типа установки. С повышением давления снижается выход бензина, уменьшается выход газов C1-С3, а также суммарное содержание олефиновых и ароматических углеводородов в продуктах каталитического крекинга. В последнее время наметилась тенденция повышения давления до 0,21-0.28 МПа при увеличении температуры процесса до ~510-530°С.
Объемная скорость подачи сырья. Время контакта сырья и катализатора определяется объемной скоростью – отношением расхода жил кого сырья (в м3/час), к объему катализатора занимающего реакционную зону.
Для пылевидного катализатора, применяют величину массовой скорости подачи сырья [в кг/(кг·ч)], определяемую аналогично объемной. Чем выше объемная скорость, тем ниже степень превращения. Повышение объемной может быть скомпенсировано более высокой активностью катализатора, а также ростом температуры. При равных температуре и активности катализатора уменьшение объемной скорости приводит к увеличению степени превращения. Объемная скорость обычно составляет от 1,5 ч-1 для шарикового и до 3,5 ч-1 для микросферического катализатора. При применении катализатора повышенной активности легче крекируемое сырье можно перерабатывать при более высоких значениях объемной скорости - до 3-5 ч-1 и выше.
Варианты контакта сырья и катализатора:
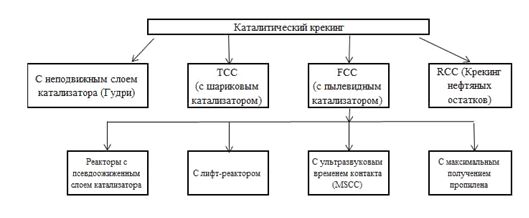
Три основных типа процессов каталитического крекинга: каталитический крекинг с флюидизированным катализатором (FCC), каталитический крекинг с перемещающимся катализатором, каталитический крекинг с термофором (TCC).
Химизм и механизм каталитического крекинга различных углеводородов.
Алканы
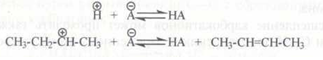
Как и при термическом крекинге, при каталитическом крекинге происходит распад молекул алкана с образованием в простейшем случае молекулы алкена и молекулы алкана меньшей молекулярной массы:
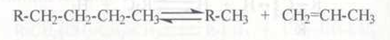
Протекает также дегидрирование с образованием алкенов. Однако по сравнению с термическим крекингом каталитический крекинг имеет ряд особенностей.
- Скорость каталитического крекинга алканов в 40–60 раз больше скорости их термического крекинга при одной и той же температуре (500 °С).
- Жидкие продукты каталитического крекинга алканов имеют преимущественно изостроение. Следовательно, в отличие от термического крекинга при каталитическом крекинге интенсивно протекает изомеризация.
- Газообразные продукты каталитического крекинга состоят из углеводородов состава С3 и С4 (пропилен, пропан, изобутилен, изобутан, бутены), в то время как в газообразных продуктах термического крекинга преобладают углеводороды состава С1 и С2 (метан, этан и этилен).
- Скорость каталитического крекинга чистых алканов резко возрастает в присутствии следов олефинов.
- Изоалканы крекируются с большей скоростью, чем алканы с прямой цепью.
Все эти особенности химизма каталитического крекинга, а также кислотный характер катализаторов привели к гипотезе об ионном механизме каталитического крекинга углеводородов, протекающего через стадию образования карбокатионов. Эта гипотеза была выдвинута американскими учеными Р. Хансфэрдом, Б. Гринсфельдером и К. Томасом.
Карбокатион – это положительно заряженный углеводородный ион, который можно рассматривать как продукт отщепления от молекулы алкана протона и пары электронов:
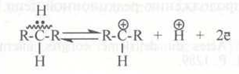
Как видно из этой схемы, для образования карбокатиона из молекулы алкана необходимо гетеролитическое расщепление связи С–Н, которое может проходить как под действием апротонного, так и протонного кислотного центра:
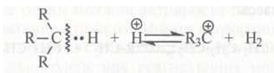
Карбокатионы могут быть первичными, вторичными и третичными:
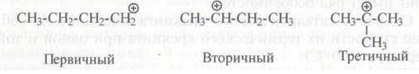
Третичные карбокатионы более устойчивы, чем вторичные и первичные, так как положительный заряд на третичном атоме углерода частично компенсирован смещением электронов от трех алкильных групп.
Образование карбокатиона из олефинов на поверхности алюмосиликатного катализатора происходит при взаимодействии протона каталитического центра с л-электронами двойной связи:
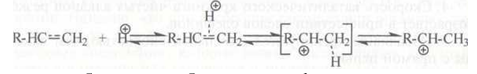
Образовавшийся карбокатион либо взаимодействует с молекулами других углеводородов, либо подвергается расщеплению. Это приводит к продолжению реакционной цепи.
Рассмотрим стадии механизма каталитического крекинга алканов.
А. Образование карбокатионов. В случае каталитического крекинга чистых алканов следы алкена, необходимого для образования карбокатиона, могут возникнуть в результате чисто термического крекинга алкана:
Далее образующийся алкен адсорбируется на кислотном протонном центре и превращается в карбокатион:

Как указывалось выше, образование карбокатиона возможно также непосредственно из молекулы алкана путем отщепления гидрид-иона под действием протонного центра

или апротонного центра катализатора: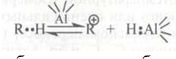
Возможность такого пути образования карбокатиона подтверждается тем, что спектры изобутилена и изобутана, адсорбированных на одном и том же катализаторе, идентичны.
Б. Реакции карбокатионов. Карбокатионы могут подвергаться различным превращениям, что приводит к развитию процесса каталитического крекинга. Все превращения карбокатионов обусловлены их нестабильностью, стремлением стабилизоваться.
Изомеризация. Первичные карбокатионы стремятся превратиться во вторичные за счет гидридного переноса (2,1-сдвиг гидрид-иона):
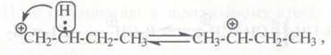
вторичные – в третичные за счет алкильного переноса. При алкильном переносе происходит переход алкиланиона (метил, этил), причем разрывается связь в (3-положении по отношению к атому углерода с положительным зарядом:
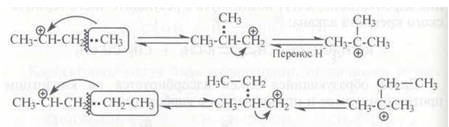
Другие алкильные группы (пропил, бутил и т. д.) в условиях каталитического крекинга легче отщепляются в виде карбокатионов, чем участвуют в алкильном переносе.
Гидридный 2,1-сдвиг протекает, по-видимому, по схеме:
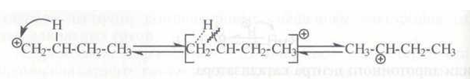
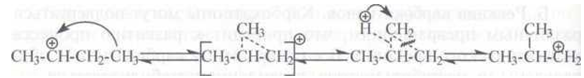
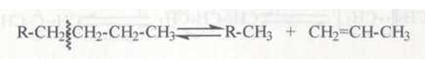
Расщепление карбокатионов. Карбокатионы стремятся стабилизироваться путем разрыва β-связи С–С с образованием алкена и нового карбокатиона:
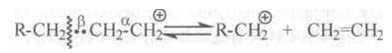
Разрыв (β-связи С–С (а не α- или γ-связи) обуславливается следующим: под действием положительно заряженного атома углерода происходит сильное смещение электронов (поляризация) у α- и β-С–С-связей; γ-связь С–С поляризуется слабее, так как она значительно удалена от положительно заряженного атома углерода:
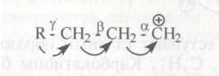
Это облегчает гетеролитический разрыв β-связи. Разрыв α- и γ-связей энергетически невыгоден, так как приводит к образованию двух нестабильных частиц.
При этом легкость разрыва β-связи увеличивается в ряду:
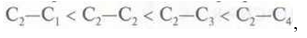
где С1 С2, С3, С4 – соответственно первичный, вторичный, третичный и четвертичный атомы углерода.
Расщепление карбокатиона по β-связи протекает тем легче, чем больше молекулярная масса образующегося при распаде нового иона.
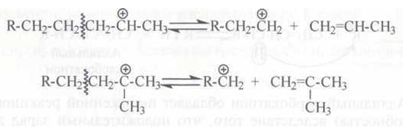
Расщепление карбокатионов может проходить также и по β-связи С–Н по отношению к заряженному атому углерода:
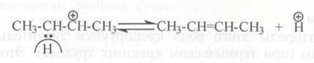
Взаимодействие карбокатионов с углеводородами. Сталкиваясь с молекулой алкана, карбокатион отрывает от нее гидрид-ион:
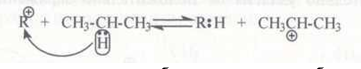
В эту реакцию вступают главным образом низшие карбокатионы CH3+, С2Н5+, С3Н7+. Карбокатионы большей молекулярной массы могут также отрывать гидрид-ионы от молекул углеводородов, однако они легче расщепляются, чем вступают в эту реакцию.
Сталкиваясь с молекулами олефинов, низшие карбокатионы присоединяются к двойной связи так же, как и протон:
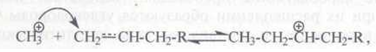
либо отщепляют гидрид-ион с образованием стабильных аллильных карбокатионов:
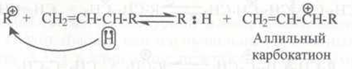
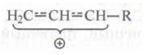
Аллильный карбокатион обладает пониженной реакционной способностью вследствие того, что положительный заряд делокализован между тремя атомами углерода:
В. Обрыв цепи: